اطلاعاتی در مورد اوربیتال اتمی
اوربیتال اتمی درمبحث شیمی معدنی به طور گسترده و زیاد مورد توجه قرار می گیرد که به انگلیسی Atomic orbital نام دارد.
همچنین تابع ریاضی است که رفتار موجی مانند یک الکترون یا یک جفت الکترون در اتم را توضیح میدهد ، این تابع را میتوان به منظور محاسبهٔ احتمال حضور الکترون در یک اتم در مناطق خاصی در اطراف هسته مورد استفاده قرار داد. از عملکرد این تابع میتوان در ترسیم نمودار سه بعدی از احتمال حضور الکترون در یک مکان استفاده کرد که این منطقهٔ فیزیکی با احتمال بالا تعیین میشود. بهطور خاص، اوربیتالهای اتمی ممکن در ویژه حالتی از یک تک الکترون که در مجموعهای از الکترونها در اطراف اتم منفرد قرار دارند را میتوان با تابع اوربیتال توضیح داد و اوربیتال اتمی که در آن الکترون به عنوان ذرات جامد است را هرگز نمیتوان با سیارهای که به صورت بیضوی به دور خورشید میگردد توضیح داد.
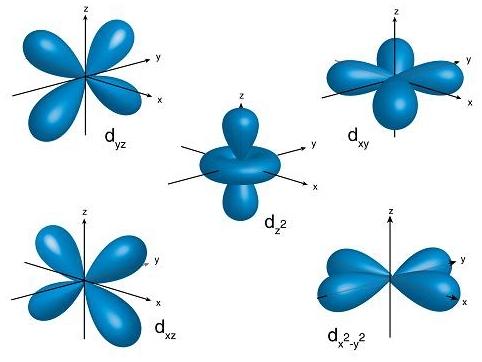
ایده ای که الکترون ممکن است در اطراف هسته با یک خاصیت چرخشی که به آن تکانهٔ زاویهای میگویند میگردد، در سال ۱۹۱۳ توسط نیلز بور استدلال شد و یک فیزیکدان ژاپنی به نام هانتارو ناگااٌکا(Hantaro Nagaoka) در اوایل سال ۱۹۰۴ فرضیه مبتنی به رفتارهای الکترونیکی به این مورد را منتشر کرد. با این حال تا سال ۱۹۲۹ معادله شرودینگر برای حل حرکت موجی الکترون در کوچکترین یا حتی بزرگترین جای اتم برای توابع اوربیتال جدید آماده نبود ،با توجه به تفاوت مدار مکانیک کلاسیک از واژه «مدار» برای الکترون در اتم، برای اولین بار شیمیدانی بنام رابرت میلیکان در سال ۱۹۳۲ اصطلاح اوربیتال را ابداع و جایگزین آن کرد. اوربیتال اتمی، معمولاً به عنوان توصیف هیدروژن گونه (به معنی یک الکترون) برای تابع موج در فضا است، اعداد کوانتومی که به صورت l,nوm دستهبندی میشوند به ترتیب متناظر هستند با انرژی جفت الکترون، تکانه زاویهای و تکانه زاویهای مسیر (بردار اقلیدسی تکانه زاویهای) و هر اوربیتال (توسط یک مجموعه از اعداد کوانتومی متفاوت تعریف میشود) که دارای حداکثر دو الکترون است، از نامهای کلاسیک در آرایش الکترونی نشان داده شده در تصویر سمت چپ نیز استفاده شدهاست. نامهای اوربیتال کلاسیک که با (s, p، d, f) نشان داده میشوند از ویژگیهای خطوط طیفی آنها مشتق شدهاست که در واقع این نامها را در تحلیل طیف گسیلی خطی فلزات قلیایی وضع کردند که f,d,p,s به ترتیب برگرفته از واژههای انگلیسی fundamental,diffuse,principal,sharp میباشند، از حدود سال ۱۹۲۰، یا حتی قبل از ظهور مکانیک کوانتومی مدرن، اصل آفبا (اصل ساخت و ساز) است که در آن اتمها متشکل از جفت الکترونهای هستند، که از تکرار یک الگوی ساده و منظم که با افزایش اعداد فرد (.. ۱، ۳، ۵،) است پیروی میکنند، توسط نیلز بور و دیگران که برای پی بردن به وجود چیزی شبیه به اوربیتال اتمی در داخل تعدادی از ساختار الکترونی اتمهای پیچیده مورد استفاده قرار گرفته بود. در ریاضیات فیزیک اتمی، برای ساده کردن تابع موج الکترون در سیستمهای پیچیده اغلب مناسب از ترکیبات سادهتر اوربیتال اتمی استفاده شود. اگرچه هر الکترون را نمیتوان در یک اتم چند الکترونی که یکی را از یک یا دو الکترون از اوربیتال اتمی در یک تصویر خیالی محدود کرد، هنوز هم تابع موج الکترون ممکن است ترکیباتی از اوربیتال اتمی را دربرداشته باشد؛ مثل اینکه در بعضی مواقع ابر الکترونی یک اتم چند الکترونی هنوز هم با اوربیتال اتمی متشکل از تنها یک یا دو الکترون باشد.
در مکانیک کوانتومی، حالت یک اتم، یعنی حالتهای انرژی با هامیلتونی آن اتم، گسترش مییابد (که توسعه آن با کاربرد جبر خطی پایهاست) که حاصل ترکیبات خطی پاد متقارن توابع تک الکترونی (دترمینان اسلیتر) است. قسمت فضایی تابع تک الکترونی را اوربیتال اتمی مینامند ، در فیزیک اتمی، خطوط طیفی اتم با انتقال (پراش کوانتومی) بین ویژه حالتهای یک اتم ایجاد میشود. این حالتها توسط یک مجموعه از اعداد کوانتومی برچسبگذاری میشود، خلاصه از نماد کوتاهی که برای آرایش الکترونی که شکل آن برای نمونه برای اتم نئون به صورت (۱s۲ ۲s۲ ۲p۶)است استفاده میشود که معمولاً در این نماد خصوصیات ظاهری و شکل تداخلی توضیح داده میشود ، مفهوم اوربیتال اتمی از یک تجسم برای یک فرایند مربوط به تحریک به حالتگذار است. به عنوان مثال، با تحریک کردن یک الکترون از یک اوربیتال به یک اوربیتال خالی فرایند گذار انجام میشود. باید به این نکته توجه داشت که برای الکترونهای فرمیون اصل طرد پاولی بر آنها حاکم است؛ و نمیتوان آنها را از سایر الکترونهای اتم متمایز کرد. علاوه بر این، ممکن است بعضی وقتها اتفاق بیافتد که نتوان از شکل تداخلی برای تعیین یک تابع موج ساده صحبت کرد که این مورد برای ارتباط الکترونی بزرگ است. اساساً تابع موج برای سیستم تک الکترونی است برای سیستمهای چند الکترونی ما برای این مورد از یک تقریب سیستم تک الکترونی استفاده میکنیم. برای این تقریب ما از تقریب (Hartree–Fock) استفاده میکنیم که این تقریب پیچیدگیهای تئوری اوربیتال مولکولی را نیز کاهش میدهد.
رابطه عدم قطعیت: بلافاصله پس از هایزنبرگ رابطه عدم قطعیت که توسط بور موجودیت یافته بود فرمول بندی شد، که در هر نوع بسته موجی دلالت بر عدم قطعیت در فرکانس و طول موج بود، از آن به بعد انتشار فرکانسها منوط به ایجاد یک بسته برای خود شده بود. در مکانیک کوانتومی، ممان تمام ذرات به امواج وابسته هستند، در شکلگیری چنین بسته موجی از متمرکز کردن ذرات موجود در فضا برای یک موج استفاده میشود. در هر جای مکانیک کوانتومی ذرات محدود به ویژه حالتها هستند، که باید در یک بسته موج متمرکز شوند، و وجود بستهها و اندازه مینیمم آنها دلالت بر انتشار و مقدار حداقلی آن در طول موج ذرات است، و همچنین با تکانه و انرژی با مقدار حداقلی طول موج ذرات در ارتباط است. در مکانیک کوانتومی، ذراتی که در یک منطقه کوچکی از فضا محدود هستند، در متراکم بودن و وابستگی بستهٔ موج نیاز به گسترهٔ بزرگی از ممان است که بنابراین آن همان بزرگی انرژی جنبشی است؛ بنابراین انرژی بستگی که حاوی یا ذراتی که در ناحیهٔ کوچک از فضا گیر انداخته شدهاند بدون محدودیت افزایش مییابند و این رشد کمتر آن ناحیه را دربردارد. ذرات نمیتوانند در یک نقطه هندسی محصور باشند چون که بینهایت ذره داریم و در شیمی افرادی مانند شرودینگر، پاولی، میلیکان و دیگران اشاره به این کردند که در رابطه هایزنبرگ الکترون به عنوان بسته موج، نمیتواند در یک مکان دقیق در اوربیتال در نظر گرفته شود.


دیدگاهتان را بنویسید
برای نوشتن دیدگاه باید وارد بشوید.