درباره ی ترمودینامیک یا گرمادینامیک

ترمودینامیک یا گرمادینامیک شاخهای از علوم طبیعی است که به بحث راجع به گرما و نسبت آن با انرژی و کار میپردازد. ترمودینامیک متغیرهای ماکروسکوپیک (همانند دما، انرژی داخلی، آنتروپی و فشار) را برای توصیف حالت مواد تعریف میکند و چگونگی ارتباط آنها و قوانین حاکم بر آنها را بیان مینماید. ترمودینامیک رفتار میانگینی از تعداد زیادی از ذرات میکروسکوپیک را بیان میکند. قوانین حاکم بر ترمودینامیک را از طریق مکانیک آماری نیز میتوان بهدستآورد و تحلیل کرد. به جنبش یک یا چند مولکول «ترمودینامیک» میگویند، پدر چهار قانون گفته میشود صفرم، اول، دوم و سوم قانون صفرم این است که اگر سیستم اول با سیستم سوم و سیستم دوم هم با سیستم سوم در تعادل است پس سیستم اول و سیستم دوم با یکدیگر در تعادل اند.
ترمودینامیک موضوع بخش گستردهای از علم و مهندسی است – همانند: موتور، گذار فاز، واکنشهای شیمیایی، پدیدههای انتقال و حتی سیاه چالهها-. محاسبات ترمودینامیکی برای زمینههای فیزیک، شیمی، مهندسی نفت، مهندسی شیمی، مهندسی هوافضا، مهندسی مکانیک، زیستشناسی یاخته، مهندسی پزشکی، دانش مواد و حتی اقتصاد لازم است و عمده بحثهای تجربی ترمودینامیک در چهار قانون بنیادی آن بیان گردیدهاند: قانون صفرم، اول، دوم و سوم ترمودینامیک. قانون اول وجود خاصیتی از سیستم ترمودینامیکی به نام انرژی داخلی را بیان میکند. این انرژی از انرژی جنبشی که ناشی از حرکت کلی سیستم و نیز از انرژی پتانسیل که سیستم نسبت به محیط پیرامونش دارد، متمایز است. قانون اول همچنین دو شیوهٔ انتقال انرژی یک سیستم بسته را بیان میکند: انجام کار یا انتقال حرارت. قانون دوم به دو خاصیت سیستم، دما و آنتروپی، مربوط است. آنتروپی محدودیتها – ناشی از برگشتناپذیری سیستم – بر میزان کار ترمودینامیکی قابل تحویل به یک سیستم بیرونی طی یک فرایند ترمودینامیکی را بیان میکند. دما، خاصیتی که با قانون صفرم ترمودینامیک تا حدودی تبیین میگردد، نشاندهندهٔ جهت انتقال انرژی حرارتی (گرما) بین دو سیستم در نزدیکی یکدیگر است. این خاصیت همچنین به صورت کیفی با واژههای داغ یا سرد بیان میگردد.
قوانین ترمودینامیک: قانون صفرم _ اول _ دوم _ سوم
قانون صفرم: اگر دو سیستم با سیستم سومی در حال تعادل گرمایی باشند، با یکدیگر همدما میباشند. بهطور مثال اگر جسم a با جسم b درتعادل گرمایی باشند و جسم b با جسم c درتعادل گرمایی باشند جسم a و c در تعادل گرمایی میباشند. اساس ساخت دماسنج قانون صفرم ترمودینامیک میباشد به این صورت که هوای محیط باشیشهٔ دماسنج در تعادل حرارتی است و شیشه دماسنج نیز با جیوه در تعادل حرارتی است در نتیجه طبق قانون صفرم ترمودینامیک هوا با جیوه نیز در تعادل میباشد.
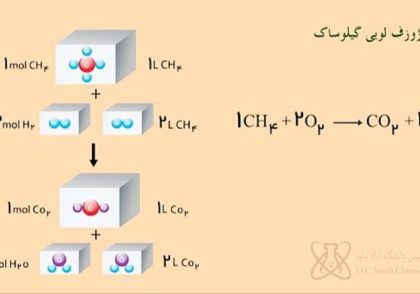
قانون اول: انرژی درونی یک سیستم منزوی ثابت و پایدار است. قانون اول ترمودینامیک که به عنوان قانون بقای کار و انرژی نیز شناخته میشود، میگوید: تغییر انرژی درونی یک سیستم برابر است با مجموع گرمای داده شده به سیستم و کار انجام شده بر آن : ∆U= Q + W
قانون دوم: ساخت یک موتور سیکلی که تأثیری جز انتقال مداوم گرما از دمای سرد به دمای گرم نداشته باشد، غیرممکن است. بیان کلوین-پلانک: غیرممکن است وسیلهای بسازیم که در یک سیکل عمل کند و در عین حال فقط با یک مخزن تبادل حرارت داشته باشد یعنی غیرممکن است یک موتور حرارتی بدون از دست دادن گرما در Qc به کار خود ادامه دهد. بیان کلازیوس:امکان ندارد که یک یخچال طی یک چرخه، تمام انرژی را که از منبع سرد دریافت میکند به منبع گرم انتقال دهد؛ یعنی نمیتوان یخچالی ساخت که بدون کار ورودی عمل کند. به عبارت ساده قانون دوم بیانگر مسیر انجام یک فرایند میباشد.
قانون سوم: قانون سوم ترمودینامیک بیان میکند هنگامی که انرژی یک سیستم به حداقل مقدار خود میل میکند آنتروپی سیستم به مقدار قابل چشم پوشی می رسد.
فرایند ترمودینامیک به دو صورت: 1_ برگشت پذیر ۲_ برگشت ناپذیر است.
فرایند برگشت پذیر: به فرایندی گفته میشود که پس از کامل شدن آن، سیستم و محیط اطراف آن نتواند به حالت اولیه خود برگردد.
فرایند برگشت ناپذیر: به فرایندی گفته میشود که پس از کامل شدن آن، سیستم و محیط اطراف قابل برگشت به حالت اولیه خود هستند. این یک فرایند ایدئال است که برای تعیین بازده ماکزیمم یک فرایند به کار میرود.
ترمودینامیک از ساخت اولین پمپ خلأ در سال ۱۶۵۰ میلادی و توسط اتو وان گریکه شروع شد اتو ثابت کرد که نظریه ارسطو مبنی بر اینکه طبیعت از خلأ متنفر است، اشتباه است. مدتی بعد فیزیکدان و شیمیدان ایرلندی رابرت بویل طرز کار دستگاه جریکو را یادگرفت و به همراه فیزیکدان انگلیسی رابرت هوک توانست اولین پمپ هوا را در سال ۱۶۵۶ بسازد که این دو توانستند بین حجم و فشار رابطهای تعریف کنند که امروزه به قانون بویل مشهور است. در سال ۱۶۷۹ شریک بویل دنیس پاپین اولین steam digester را ساخت که یک ظرف دربسته با در محکم بود که در آن بخار با فشار بالا تولید میشد، مفاهیم پایه برای گرمای ویژه و گرمای ویژه نهان توسط جوزف بلک در دانشگاه گلاسکو، جایی که جیمز وات به عنوان ابزار ساز کار میکرد آرایه شد. جیمز وات با بلک دربارهٔ افزایش بازدهی موتور بخار مشورت کرد اما این خود وات بود که ضرورت وجود چگالنده بخار خارجی را برای افزایش بازدهی گرمایی موتور بخار پیشبینی نمود و سعدی کارنو، پدر ترمودینامیک، با توجه به تمامی کارهای قبلی مقالهای با عنوان ایدههایی دربارهٔ حرکت جنبشی آتش منتشر نمود. این مقاله دربارهٔ گرما، قدرت، انرژی، و بازدهی موتور بحث میکرد. این مقاله روابط بین موتور کارنو، چرخه کارنو، و قدرت حرکتی را مورد بحث قرار میداد. مقاله کارنو سرآغازی بر علم ترمودینامیک به عنوان دانشی نوین شد همچنین نخستین کتاب ترمودینامیک توسط ویلیام رانکین که فیزیک خوانده بود و به عنوان استاد مهندسی مکانیک و عمران در دانشگاه گلاسکو کار میکرد، در سال ۱۸۵۹ منتشر گردید. همزمان قانون اول و قانون دوم ترمودینامیک در دهه ۱۸۵۰ میلادی بر اساس کارهای رانکین، رودلف کلاوزیوس و ویلیام تامسون نگاشته شد.
مبانی ترمودینامیک آماری توسط جیمز کلرک ماکسول، لودویگ بولتزمان، ماکس پلانک، رودلف کلاوزیوس و جوسایا ویلارد گیبس بنیان گذاشته شد. در بین سالهای ۱۸۷۳ تا ۱۸۷۶ جوسایا ویلارد گیبس سه مقاله منتشر نمود که مشهورترین آنها تعادل مواد ناهمگون میباشد. گیبس همچنین نشان داد که چگونه پروسههای ترمودینامیکی شامل فعل و انفعالات شیمیایی را میتوان به صورت نموداری نشان داد، او نشان داد که چگونه میتوان روی دادن خود به خودی واکنشها را از روی انرژی، انتروپی، حجم، پتانسیل شیمیایی، دما و فشار در سیستمهای ترمودینامیکی پیشبینی نمود. ترمودینامیک شیمیایی بعد تر توسط پیر دوهام، گیلبرت لوویس، مرل لاندل و ادوارد گوگنهایم توسعه بیشتر یافت.
پست های مرتبط
مهر 5, 1403






دیدگاهتان را بنویسید
برای نوشتن دیدگاه باید وارد بشوید.